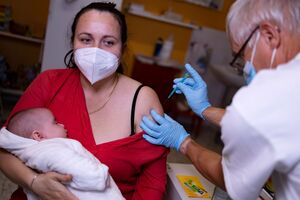
Covid-19: Regulador europeu aprova utilização de vacinas a partir dos seis meses
Comité de Medicamentos de Uso Humano da Agência Europeia de Medicamentos concluiu que "os benefícios" daquelas vacinas "superam os riscos".

Comité de Medicamentos de Uso Humano da Agência Europeia de Medicamentos concluiu que "os benefícios" daquelas vacinas "superam os riscos".

Segundo a agência europeia, este medicamento da farmacêutica Pfizer está recomendado, nesta fase, para adultos que não precisam de oxigénio suplementar e que correm maior risco de desenvolver uma forma grave de covid-19.

Na sequência da recomendação da EMA, cabe agora à Comissão Europeia emitir a decisão final sobre a utilização deste medicamento para a covid-19 nos Estados-membros.

Caso a vacina da farmacêutica norte-americana receba a "luz verde" do regulador, será a quinta autorizada para a União Europeia.

O molnupiravir destina-se a ser tomado duas vezes por dia durante cinco dias por pessoas que estejam em casa com covid-19 ligeira a moderada.

Do total de 36 situações graves detetadas "cinco motivaram hospitalização e 31 foram considerados clinicamente relevantes", tratando-se de pessoas que testaram positivo para o vírus SARS-CoV-2 mais de 14 dias após terem recebido a vacina de toma única.

A Agência Europeia de Medicamentos vai debruçar-se sobre os benefícios e riscos da administração de uma dose de reforço seis meses depois da segunda para "restabelecer a proteção".

Em abril, DGS e task-force previam a chegada de 733 mil doses da Curevac e cerca de 350 mil da Novavax para o segundo trimestre deste ano. Vacinas estão em análise no regulador europeu desde fevereiro.
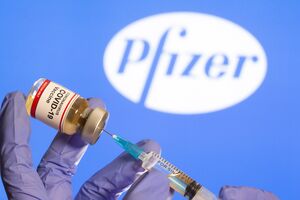
Agência Europeia do Medicamento vai anunciar se autoriza ou não a adminstração de doses da vacina da Pfizer/BioNTech em jovens entre os 12 e os 15 anos.

Ursula von der Leyen congratulou-se com a "luz verde" da Agência Europeia do Medicamento à vacina da Moderna, garantindo que a Comissão Europeia trabalha "a toda a velocidade" para a tornar disponível na UE.

O Infarmed revelou ainda que, após contacto com o laboratório titular do medicamento, este confirmou que "antecipa que não venha a existir qualquer constrangimento no acesso ao tratamento por parte dos doentes portugueses".

"Dominamos toda a fase da técnica e não precisamos de recorrer a nenhuma outra instituição", disse o presidente do Conselho de Administração do CHMT.

Avaliada a segurança e eficácia.